季懋欣醫師
今年的諾貝爾醫學獎得獎的主題是細胞如何感應與適應氧氣變化的機制與基因活性的調節。得獎的科學家為美國的 William George Kaelin、Gregg L. Semenza和英國Sir Peter J. Ratcliffe。這對組合在2016年也得到Albert Lasker Basic Medical Research Award的殊榮。
Erythropoetin (EPO,紅血球生成素) 合成幫助適應缺氧環境
EPO的濃度升高能夠增加紅血球合成(erythropoeisis)提高攜氧量。人體處在缺氧環境或是貧血時,EPO濃度會上升,由於紅血球的功能是攜帶氧氣,病人的精神跟體力在氧氣濃度升高後也會有所改善。EPO臨床上應用在慢性腎病與貧血病人上。
Dr. Gregg Semenza與Peter在95年小鼠實驗發現一種缺氧誘導分子(hypoxia-inducible factor,HIF)的蛋白質複合物與EPO能相互作用。
這個HIF,擁有α與β兩種結構,HIF-1α普遍被認為與調控EPO的表現較為相關。
- 當氧氣充足時,HIF-1α 與prolyl hydroxylase作用,迅速被ubiquitin(蛋白)標記分解掉(ubiquitin-proteasome pathway)。
- 缺氧時,HIF-1α不會被代謝掉,它會與HIF-1β結合,表現出增加血管新生與分泌促進生長的因子。
VHL(von Hippel–Lindau)基因
Dr. William研究von Hippel–Lindau基因。VHL是腫瘤抑制基因,若基因突變了就沒法壓抑住疾病變化的產生而生成癌症。
- 1904年由德國眼科的Eugen von Hippel首先報告眼睛變異的血管瘤。
- 在1926年瑞典的病理醫師Arvid Lindau發現腦部和脊椎的血管瘤。
- 一部分腎臟癌患者被認為有VHL缺失。
VHL 基因缺失也會響應缺氧的環境。失去VHL基因,HIF-1α就沒有辦法被分解掉,HIF-1α接著與HIF-1β合併,進而增加血管新生,紅血球生成與糖解作用。
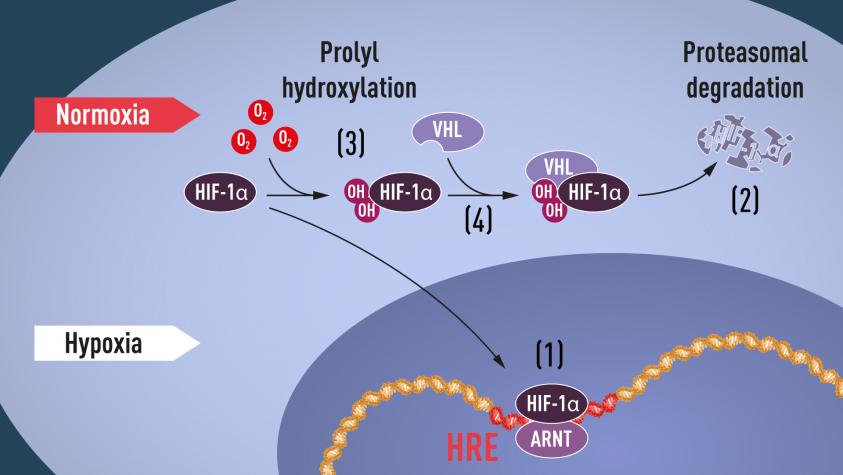
本圖為Nobel的機制圖。
在有氧的環境下,HIF-1α經prolyl hydroxylase水解與VHL作用(3, 4),會很快被分解掉(2)。
在缺氧的環境下,HIF-1α在無法被代謝的情況下,會進一步活化細胞生長(1)。
對氧濃度變化的複雜分子機制反應,數分鐘內就在細胞發生!!
癌細胞特色之一是缺氧
缺氧會讓癌變得更惡性,以及更容易產生抗藥性。HIF-1α不被代謝掉,血管新生增加,糖解作用增加,讓整體環境趨向”酸化”。
Dr. Semenza在得獎記者會上表示: 多數化療藥物只能殺死正在分裂中、不缺氧的癌細胞,卻沒有治療方式能針對缺氧的細胞,「我們認為這些缺氧細胞會戰勝化療,重新復活,最終殺死病患。」
在癌症治療研究,抑制HIF分解可以調控血管形成;另一方面調節HIF分解,理論上也可輔助目前的治療,達到更好的治療效果。
Nobel Press: https://www.nobelprize.org/prizes/medicine/2019/press-release/
